Приложения
Приложение 9. Статья Валерия Алексеевича Легасова "Гелий. Сегодня - сверхокислитель. Завтра - сверхтопливо?" в журнале «Химия и жизнь» №2, 1976г.
Гелий. Сегодня - сверхокислитель. Завтра - сверхтопливо?
Журнал «Химия и жизнь» №2, 1976г.
Для многих разделов химии полтора десятилетия — срок небольшой. Для химии благородных газов 14 лет — век. В 1962 г. был синтезирован гексафторплатинат ксенона — первое истинно химическое соединение газа, считавшегося прежде инертным. Вскоре последовали другие подобные синтезы. Все реакции шли достаточно спокойно, но реакция химиков на них была бурной.
РЕАКЦИЯ НА РЕАКЦИИ
Синтез первых соединений благородных газов воспринимался как сенсация. Публиковались работы под такими, например, названиями, как «Кошмар благородных газов» и «Вызов теоретической химии». Человек, которому никак не откажешь в компетентности, известный американский химик Д. М. Иост, не без излишней высокопарности писал: «Открытие фторидов ксенона и других благородных газов не будет забыто, пока человек проявляет интерес к химии».
Науке избыточные эмоции всегда вредны. Но и до сих пор иногда приходится сталкиваться с неверными оценками как самого факта открытия Н. Бартлетом первого химического соединения ксенона, так и последующего развития этой области химии.
Избыточные эмоции прошлого были вызваны укоренившимися представлениями о неприступности замкнутых электронных оболочек, и в частности восьмиэлектронной оболочки s2p6. Напомним, что такая оболочка есть у атомов всех благородных газов, кроме гелия, и эта оболочка — внешняя.
Представление о химической невосприимчивости таких оболочек было основано на огромном экспериментальном материале. Оно легло в основу всех ранних теорий химической связи. Казалось, ничто не может поколебать его, ибо оно просто, как все великое. Атомы соединяются в молекулы затем, чтобы дополнить друг у друга незаполненные электронные оболочки, т. е. достичь дна энергетического океана, ниже которого и погружаться некуда. Так считали теоретики — с этих же позиций воспринимались и данные химических экспериментов.
Математизация химии несколько пошатнула это прочное сооружение. Лайнус Полинг — физик, принесший в химию инструменты квантовой механики, точными расчетами показал (еще в 1933 году!), что восьмиэлектронная оболочка не всегда обладает минимальной энергией. Отсюда следовало, что тяжелые благородные газы должны образовывать химические соединения. Полинг даже предсказал относительную устойчивость таких соединений, как KrF4, Н4ХеО6 и XeF6.
Нельзя сказать, что работы Полинга остались без внимания. О. Руфф в Германии и Д. М. Иост в США попытались получить вещества, предсказанные Полингом, но подвело несовершенство экспериментов.
И ксенон, и фтор, а именно с этими газами экспериментировали, в то время были редкостью. Экспериментаторы располагали ими, но в крайне малых количествах и не располагали, естественно, современными методами инструментального анализа. Они просто не заметили образования фторидов ксенона. А может, побоялись заметить? Позднее Иост сокрушался, что мог сделать открытие, да не сделал. Но так или иначе, хотя подвел эксперимент, сомневаться стали в теории...
Лишь когда благородные газы и фтор стали доступны, когда был накоплен опыт работы с фтором и агрессивными фторидами, когда в химию пришли разнообразные физические методы исследований, вот тогда открытие соединений благородных газов стало возможным и, пожалуй, даже естественным.
Таким образом, распространенное мнение, будто относительная активность тяжелых благородных газов противоречит основам химии — не более чем заблуждение. Характерно, что любые попытки придумать для этих соединений какие-то свои, присущие только им особенности и виды химических связей неизменно оказывались бесплодными. С точки зрения современной химии это вполне обычные вещества, подчиняющиеся всем основным законам и правилам, действующим в мире веществ.
ВЕЩЕСТВА КАК ВЕЩЕСТВА
Еще одно распространенное заблуждение — представление о соединениях благородных газов как о веществах экзотических, немногочисленных, очень неустойчивых и аномальных, если не по всем характеристикам, то почти по всем.
Трудно сказать, на чем основано это заблуждение. В нашей стране очень многие соединения благородных газов химикам не менее доступны, чем обычные реактивы. Тем не менее заблуждение о сверхэкзотичности соединений благородных газов живо до сих пор. Когда по инициативе авторов этой статьи и их сотрудников «Союзхимреактив» выпустил рекламный проспект на некоторые из таких веществ, один весьма уважаемый и известный ученый воскликнул: «Надо же! Нашлись авантюристы, которые производят и продают фториды ксенона!» А в это время уже во многих лабораториях страны работали с десятками и сотнями граммов этих «авантюристических» фторидов.
Чтобы опровергнуть это заблуждение достаточно аргументированно, расскажем коротко о характерных свойствах соединений благородных газов.
Пока три таких газа — радон, ксенон и криптон — удалось заставить вступить в химические реакции. Казалось бы, самым реакционноспособным из трех должен быть радон — внешние электроны удалены от ядра на большее расстояние и оттого меньше им притягиваются. Следовательно, и оторвать их легче.
Такое рассуждение логично, но оно не учитывает радиоактивности радона. Собственное излучение разрушает связи, происходит радиолиз. Из-за малых периодов полураспада изотопов радона и высокой их альфа-активности соединения этого элемента изучены даже хуже, чем у самого легкого из неинертных инертных газов — криптона...
Больше всего получено соединений ксенона. Этот элемент уже представлен во всех основных классах химических соединений. Хорошо изучены его галогениды, окислы, кислоты, соли оксикислот, комплексные соединения и т. д. В таблице представлены не просто соединения радона, ксенона и криптона, а классы соединений. Так что за каждой формулой там стоит, как правило, не одно вещество. Беглого взгляда на таблицу достаточно, чтобы понять: сегодня химия ксенона намного богаче, чем криптона или радона. А всего сейчас известно больше 150 соединений этих элементов. В этой ситуации вряд ли можно говорить о редкости подобных соединений.
Может быть, физические свойства соединений благородных газов выделяют их как-то из массы обыкновенных веществ? Ничуть не бывало. В основном, при обычных условиях это твердые мелкокристаллические вещества плотностью около 5 г/см3, диамагнетики и диэлектрики. Температуры их плавления, как правило, лежат за пределами 100°С, часть веществ возгоняется без плавления и разложения.
Впрочем, температура разложения — это уже показатель химической стойкости. Но и по химическим свойствам большинство соединений благородных газов не представляет собой ничего из ряда вон выходящего. Кислоты как кислоты, галогеннды как галогениды и т. д. Конечно, есть у них некоторые особенности, но попробуйте найти среди наипривычнейших веществ вещество без индивидуальных особенностей. Таких веществ нет и быть не может. Вернемся, однако, к химической стойкости соединений благородных газов.
Таблица, в которую сведены наиболее изученные соединения радона, ксенона и криптона
(М – металлы)
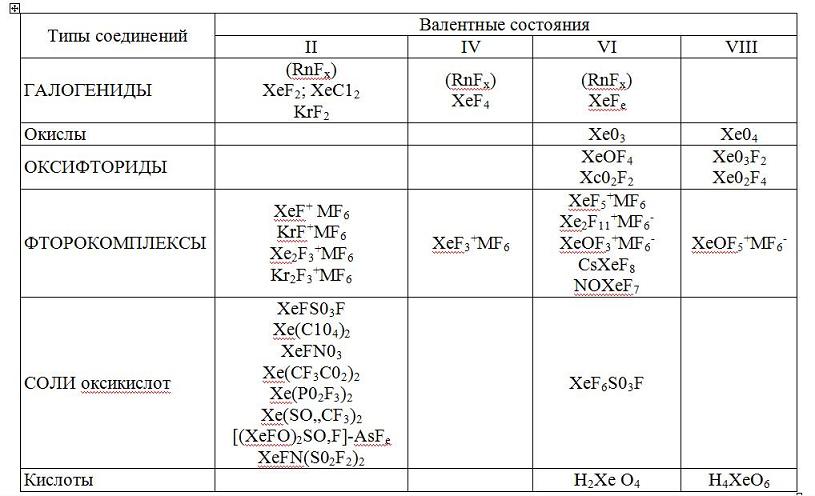
У большинства из них и здесь показатели вполне обычные. Почти все эти вещества можно нагревать, не опасаясь, до 100°С и выше, многие из них не разлагаются и при перегонке.
Особняком стоят лишь несколько соединений — окислы ксенона, его перхлорат и трифторацетат. Эти вещества термодинамически неустойчивы и взрывоопасны. Взрывчатые свойства трехокиси ксенона ХеО3 заставляют обращаться с ней с особой осторожностью, как с мощным инициирующим взрывчатым веществом. Но, как и многие взрывчатые вещества традиционных классов, ХеОз можно флегматизировать.
Нитроглицерин «укрощается», теряет взрывчатость, при растворении в этиловом или метиловом спирте, трехокись ксенона — при растворении в воде. При этом — что очень важно — Хе03 сохраняет свойства сильного окислителя. К окислительным свойствам как важной отличительной особенности некоторых соединений благородных газов мы еще вернемся.
Логичен вопрос: с какими элементами схожи вступающие в реакции благородные газы? Ответ на него не однозначен. С одной стороны, как и положено элементам восьмой группы, в своих соединениях они переходят в разные окислительные состояния (валентности): II, IV, VI, а иногда даже VIII. Газообразная при обычных условиях четырехокись ксенона во многом подобна газообразной же четырехокиси платинового металла осмия. Как и осмий, реагируя с фтором, ксенон не образует высшего фторида состава XeF8, но зато оксифториды состава 302F4 образуют и ксенон, и осмий.
Но не все так просто и однозначно. В других случаях, в других реакциях ксенон и его аналоги проявляют сходство и с галогенами, и с переходными металлами не только восьмой группы. При всей обычности соединений благородных газов в индивидуальности им все-таки не откажешь. Индивидуальность эта начинается с самого начала — с методов получения.
ТОЛЬКО ЧЕРЕЗ ФТОР
Еще раз обратимся к таблице. Соединений благородных газов, особенно ксенона, много. Разные химические элементы в лице ксенона (реже радона и криптона) нашли неплохого партнера. Все эти разнообразные, по составу вещества получены из фторидов. Да, пока лишь фтор и только фтор способен расшатать линию обороны восьмиэлектронных оболочек.
Что касается фторидов ксенона, то способ их получения предельно прост. Ксенон — газ, считавшийся прежде инертным, сгорает во фторе ярким желтым пламенем и за доли секунды превращается во фториды. Горение сопровождается выделением больших количеств тепла, и можно было бы использовать смесь фтора с ксеноном в качестве топлива, будь эти газы более доступны (а фтор еще и не столь агрессивен).
Синтез дифторида криптона сложнее. Для того чтобы получить это соединение, нужно совместить, казалось бы, несовместимое.
Окислительных способностей наиагрессивнейшего фтора для химического взаимодействия с криптоном недостаточно. Это под силу лишь атомарному фтору, а чтобы разложить молекулы фтора на атомы, нужно затратить энергию, например сильно нагреть фтор. Но с другой стороны, для того, чтобы образующиеся фториды криптона не распадались, нужно понизить их энергию, воспользовавшись, например, приемом низкотемпературной закалки. Вот и получается, что для одного и того же процесса одновременно нужны и очень высокие и очень низкие температуры. Поскольку совместить то и другое нельзя, используют обходные пути. На охлажденную до минус 200°С смесь фтора с криптоном воздействуют высоковольтным электрическим разрядом. Или излучением. Или еще какими-то «сильнодействующими средствами». Например, раствор криптона в жидком фторе (—196°С!) пронизывается потоком ультрафиолетового излучения мощностью в сотню ватт. В тридцатых годах, когда делали первые опыты по взаимодействию фтора с благородными газами, такая экспериментальная техника, конечно же, была недоступна.
Когда фториды криптона или ксенона получены, в ход идут методы традиционной химии. Весь спектр известных ныне соединений благородных газов получен в обычных реакциях присоединения, замещения или комплексообразования. Комплексных соединений больше всего, в чем нетрудно убедиться, еще раз взглянув на таблицу.
ОКИСЛИТЕЛИ, КАКИХ МАЛО
Главное, что выделяет соединения благородных газов в мире веществ, это их уникально высокие окислительные потенциалы. Самый сильный ион-окислитель — это перксенат-ион ХеО64- (заметим, что для успешной работы ему нужна кислая среда). Соли-перксенаты по составу и свойствам близки к подобным соединениям элементов седьмой группы — перхлоратам и периодатам, но превосходят их по силе окисляющего действия.
Интересно, что аналогичные соединения семивалентного брома — перброматы химики пытались получать давно и безуспешно, хотя были перепробованы десятки методов и реакций. Перброматы (МВг04) удалось получить лишь в наши дни, после открытия неинертности инертных газов. Окисляющим агентом, позволившим получить эти важные для химической теории вещества, стали водные растворы XeF2.
Окислы ксенона, взрывоопасность которых мы отмечали выше, оказались (в виде растворов) исключительно удобными окислителями. Такой окислитель не привносит в процесс ничего постороннего, а продукты реакции — газообразные кислород и ксенон — удаляются очень легко.
Высокие окислительные потенциалы свойственны и многим комплексным соединениям благородных газов. Например, комплексы двухвалентного ксенона способны превратить в катионы окись азота и хлор, а аналогичные соединения криптона окисляют даже кислород и трехфтористый азот. С помощью дифторида криптона удается получить даже соединения пятивалентного (!) золота. А еще дифторид криптона уникален тем, что в нормальных условиях может генерировать атомарный фтор.
Сегодня редкостные окислительные свойства соединений благородных газов используют в основном лишь в лабораторной практике. С их помощью анализируют минералы, синтезируют уникальные медицинские препараты (например 5-фторурацил), окисляют то, что другими способами нельзя окислить. Но естествен вопрос: а что будет завтра?
И вообще, что ждет химию благородных газов — останется ли она лишь красивой «игрушкой» в руках исследователей пли, подобно большинству разделов химии, станет приносить пользу человечеству в целом?
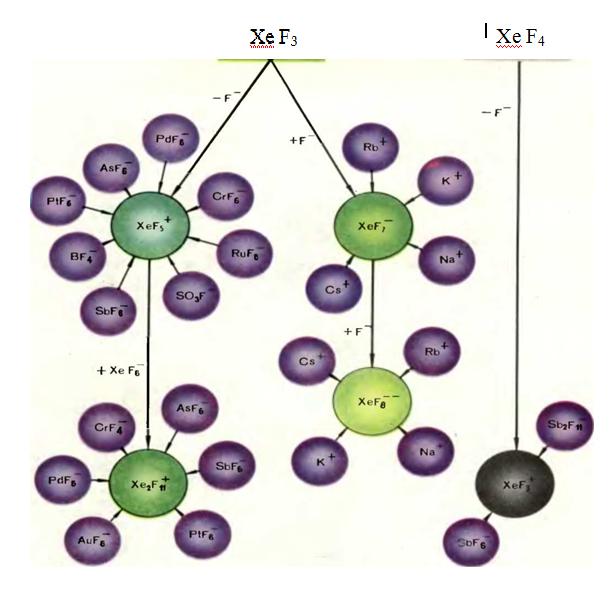
Рассмотрим рисунки, которые можно назвать «диаграммами с цветочками». Разобравшись в них более или менее внимательно, вы убедитесь, что многие криптон- и ксенонсодержащие группы обладают высокой реакционной способностью. Диаграммы показывают многообразие соединений, получаемых с их помощью. При желании «диаграммы с цветочками» можно понимать и так: нынешние достижения химии благородных газов — это еще цветочки... Ягодки впереди
ЯГОДКА» ЭНЕРГЕТИЧЕСКАЯ
С точки зрения экологической безопасности атомные электростанции высоконадежны: вероятность аварийного радиационного заражения ими окружающей среды меньше, чем вероятность падения искусственного спутника Земли на городского жителя. Но о потенциальной опасности мирной ядерной энергетики приходится думать уже сегодня, и вот почему.
При делении ядер урана образуются газообразные осколки — радиоактивные изотопы 85Кг и 133Хе. При нынешней распространенности ядерных энергетических установок эти выбросы не представляют даже локальной опасности. Пока их еще можно (см. «Химию и жизнь», 1975, № 7) сбрасывать в атмосферу: масштабы загрязнения так же невелики, как и масштабы производства. Но темпы развития атомной энергетики в мире таковы, что уже в следующем десятилетии локальные загрязнения атмосферы изотопами 85Кг и 133Хе могут подойти к опасному рубежу. Следовательно, прогнозируемые масштабы развития атомной энергетики были бы затруднительны без решения задач улавливания радиоактивных изотопов криптона и ксенона.
Именно химическое улавливание этих радиоактивных газов представляется наиболее перспективным. Например, для улавливания ксенона может быть использована его реакция с диоксигенильными солями (например, 02SbF6), в результате которой ксенон свяжется в соединение XeFSb2F11, а в атмосферу вместо радиоактивного газа выделится кислород. К сожалению, не создан еще окислитель, способный так взаимодействовать с криптоном.
Каковы перспективы синтеза такого окислителя? Ответить на этот вопрос — значит ответить и на вопрос о перспективах развития всей химии благородных газов.
Ясно, что количество синтезируемых соединений ксенона и криптона будет множиться, и возможности здесь большие. Образование связей ксенон — углерод, ксенон — сера, ксенон — бор вполне вероятно. Но соединения такого типа вряд ли смогут окислить криптон. Ведь потенциал ионизации криптона — 14 электрон-вольт, и чтобы окислить его, надо иметь соединение, содержащее группу со сродством к электрону по крайней мере не ниже 14 эв. Такими группами могли бы быть ArF+ и N2+ (сродство к электрону 14,1 и 15,58 электрон-вольт соответственно) в соединениях ArFMF6 и N2MF6 (М — какой-либо металл). Но вещества подобного состава существуют пока лишь в умах теоретиков.
«ЯГОДКА» СВЕРХЭНЕРГЕТИЧЕСКАЯ ?
Синтез соединений аргона не только обогатит химию благородных газов, но и расширит возможности неорганической химии в целом. Такому супермощному окислителю многое будет по плечу, в том числе связывание и окисление криптона. Запас химической энергии в таких окислителях лежит на границе возможностей традиционной химии. Большего окислительного потенциала можно ожидать лишь для групп F2+ и F+, однако сегодня нет оснований надеяться на получение достаточно устойчивых соединений типа F1 + MF- и F + MF-.
Запасать энергию в химических соединениях можно, наверное, и другим способом: вводить в химические соединения атомы и ионы в электроновозбужденном состоянии. Если каким-то (пока не ясно, каким) способом удастся стабилизировать такие вещества, возможности неорганической химии расширятся многократно.
Кое-какие предпосылки для этого дает химия благородных газов. Известно, что электроновозбужденные атомы всех благородных газов обладают высокой химической активностью и могут вступать в реакции друг с другом, с водородом и с некоторыми молекулами:
Не*+Н — Не*Н
Хе*+Хе — Хе*Хе
Хе*+Кг — Хе*Кг
(звездочкой отмечены атомы благородных газов в возбужденном состоянии). Продукты таких реакций живут лишь до тех пор, пока не снято возбуждение.
Если такое вещество будет находиться в виде газа, то возбуждение быстро пройдет — из-за потерь энергии в столкновениях необычных молекул между собой и с обычными молекулами. Результатом будет быстрый распад молекул, в которые входят возбужденные атомы. Но если такие молекулы зафиксировать в жесткой кристаллической решетке, да еще при этом химически связать их, то тогда они смогут существовать неограниченно долго.
И тогда... Тогда появится принципиально новая химия с совсем другими энергетическими масштабами. К примеру, при самой экзотермической из обычных химических реакций — реакции водорода с фтором — выделяется около 5 килокалорий на грамм вещества. А энергия перехода гелия из возбужденного состояния в основное равна 114 ккал на грамм!
Трудно переоценить полезность столь высокоэнергетичного химического топлива. И хотя приведенные чуть выше построения пока в основном из области рассуждений, любые попытки синтезировать подобные, действительно необычные, химические соединения заслуживают, на наш взгляд, внимания и одобрения. На всех уровнях — энергетических и организационных.
Доктор химических наук В. А. ЛЕГАСОВ,
кандидат химических наук Б. Б. ЧАЙВАНОВ,
Институт Атомной Энергии им. И. В. Курчатова.
ГЛАВНАЯ (содержание)
ИЛЛЮСТРАЦИИ
ПРИЛОЖЕНИЯ
ЗАКЛЮЧЕНИЕ
Методология общения с Богом
Литература
Об авторе
|

